近日,中南大学湘雅二医院皮肤性病科医学表观基因组学湖南省重点实验室主任、中国医学科学院免疫性皮肤病基础与转化重点实验室主任陆前进教授,中南大学湘雅二医院皮肤性病科医学表观基因组学湖南省重点实验室吴海竞副研究员带领研究团队,联合香港免疫学会主席、香港大学吕立为教授在国际著名自身免疫病期刊《Journal of Autoimmunity》(IF:7.094)在线发表题为“A Novel Humanized Cutaneous Lupus Erythematosus Mouse Model Mediated by IL-21-induced Age-associated B Cells”的研究论文。吴海竞教授和陆前进教授为共同通讯作者,其团队李倩文博士和周素清硕士为共同第一作者。
该研究创新性地建立了一种理想的人源化皮肤型红斑狼疮动物模型,该模型呈现了人源化的异常免疫微环境及皮肤型红斑狼疮的典型组织病理改变, 该研究进一步探讨了该模型中细胞因子白介素21(IL-21)和Toll样受体7/9(TLR7/9)信号在年龄相关B细胞(age-associated B cells,ABCs)分化和狼疮发病机制中的重要作用,该模型已获国家发明专利【专利号ZL202010110769.4】,未来可用于探讨红斑狼疮疾病的发生机制以及靶向狼疮皮损的药物研发等研究,推进科研成果的临床转化。

红斑狼疮(lupus erythematosus, LE)是一种慢性、易复发的自身免疫性疾病,根据损伤的器官可分为皮肤型红斑狼疮(CLE)和系统性红斑狼疮(SLE),皮肤受累发生在大多数红斑狼疮患者中,约5%的播散性皮肤型红斑狼疮随后发展为多系统累及。目前尚不清楚从皮肤损伤进展为多器官系统受累的分子机制。由于缺乏CLE免疫学机制的确凿证据,且尚无典型的CLE小鼠模型,CLE发病机制研究和潜在药物开发存在较大的挑战。因此构建新型的人源化CLE小鼠模型及其相关的免疫学机制研究有重要意义。
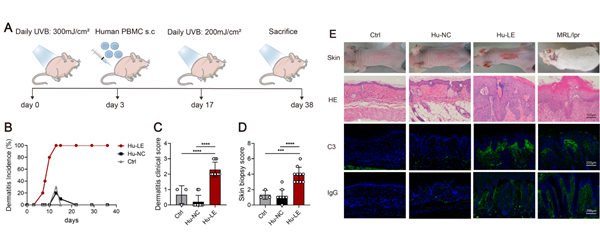
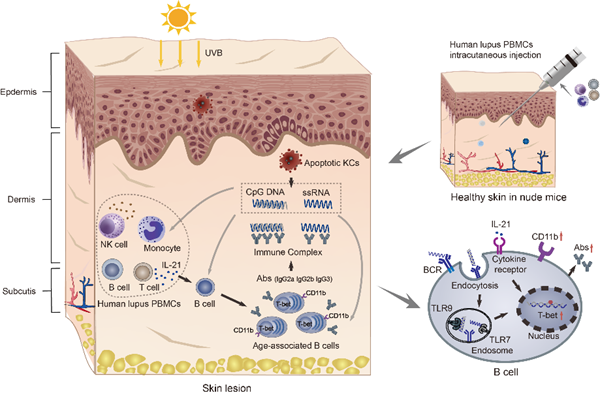
通过来自活动性狼疮患者的外周血单个核细胞重建免疫缺陷小鼠的局部免疫系统,利用UVB辐射作为致病性诱因,建立理想的人源化CLE小鼠模型。所构建的新型人源化小鼠出现持续性红斑和狼疮样组织病理学变化,包括毛囊角栓,基底细胞液化变性,炎症细胞浸润和基底膜带C3、IgG免疫复合物沉积,而没有尿蛋白和血清自身抗体等系统受损的证据;研究进一步揭示狼疮样皮损中细胞因子IL-21的富集和ABC细胞的异常浸润;另外,体外刺激实验证明IL-21驱动静息B细胞向ABC细胞的分化,且TLR7和TLR9激动剂辅助刺激能抵抗IL-21的促凋亡作用,并且维持更强的分化为ABC细胞能力,细胞荧光显示ABC细胞呈现出浆细胞样的形态,qPCR结果显示B细胞响应IL-21和TLR信号的刺激呈现出和浆细胞类似的mRNA水平的改变,且发现ABC细胞在体外分泌IgG2a,IgG2b和IgG3抗体,而不分泌IgG1。揭示了其在狼疮发病机制中的重要作用和潜在机制,该创新性的模型具有人源化的特点并将作为有力的载体进行针对狼疮皮损的治疗药物探索。
原文链接:https://www.sciencedirect.com/science/article/pii/S0896841121000949?dgcid=coauthor
初审:谢宇波
复审:谢琳
终审:刘新
